細胞性食品(「培養肉」)の安全性|政府の議論まとめ
執筆者:吉富愛望アビガイル
はじめに
※本記事の内容は、細胞農業研究機構の個別の会員企業の意見や、その総意ではございません。あくまでも筆者個人の意見です。情報整理の過程での解釈ミスなどがあるかもしれませんので、ご意見やご質問、お気づきの点がございましたらぜひご連絡ください(お問合せページこちら)。皆様とのコミュニケーションの方で、今後とも一層、質の高い情報発信、皆様の知りたい情報の発信を心がけたいと思いますので、何卒どうぞよろしくお願いいたします。
今回は、「細胞性食品」という言葉を使います。これは「培養肉」とも呼ばれますが、消費者の従来食品との誤認を比較的に防ぎ、畜産業界や、昔ながらの発酵産業(培養工程が生産工程に存在する)に配慮した言い方で、農林水産省や経済産業省が使った実績があります。
さて、日本で細胞性食品の販売手続きがどうなるか、どうやって安全安心に生産するかなどについて、消費者庁の「食品衛生基準審議会 新開発食品調査部会(以下、調査部会)」で話し合いが行われています。 今年の夏頃には、ガイドラインの中間案(途中の案)が発表されるかもしれないというタイミングで、先日今年度最初の調査部会の開催が発表(https://www.caa.go.jp/policies/council/fssc/meeting_materials/review_meeting_004/043034.html)されました。当日の議論をより深く理解するために、これまでの話し合いの内容をまとめてみました。
目次
今どこまで議論が進んでいるの?
私の理解では、調査部会では次のような話し合いが進んでいます。
1. 議論の進め方について
- ガイドライン案は、「国立医薬品食品衛生研究所」を中心にした作業部会というグループで考えられています。
(つまり、まず作業部会が案を作って、それを調査部会で検討するという流れです。) - 今年の夏頃までに、中間案を調査部会に出す予定になっています。
- 同時に、「規制(ルール)をどうするか」についても議論されています。
2. 安全性に関するチェック項目
調査部会の事務局(消費者庁)が、次の項目に沿って議論してはどうかという提案を行っていました:
- 細胞をとった動物や細胞そのものが安全か?―「由来動物・細胞の安全性」
- 細胞を育てるときに使う物質は安全か?―「培養時の使用物質の安全性」
- 食品として加工したときに、どんな変化が起きるか?―「食品加工による変化」
- 異物(コンタミネーション)が入らないように、作業工程はしっかり管理されているか?―「コンタミネーションに係る作業工程の管理」

https://www.caa.go.jp/policies/council/fssc/meeting_materials/assets/fscc_cms105_250127_04.pdf

https://www.caa.go.jp/policies/council/fssc/meeting_materials/assets/fscc_cms105_250221_01.pdf
過去の議論の経緯について知りたい
今年の2月までの調査部会の議論について、詳しく知りたい方は次の関連リンクからご確認ください。
下記表を見るときの大きなポイントとしては、
- 2024年4月1日より厚生労働省から消費者庁への食品衛生基準行政の移管が行われているため、調査部会の会議体が変化していること
- 議事次第内での取り扱いが変化したこと。もともと「その他」~数ある話題の一つで、議論に割かれる時間も短かった。そして、移管前後にかけて「紅麹問題」があったため、2025年3月期(2024年度)の最初の半年は話題に挙がらなかったとみられるが、2024年11月18日の会議以降は最優先議題として多くの時間が割かれ始めた
- 2024年度は(調査部会はまだ3回分の開催である点や、出席者に係る議事録への記載形式が変化したため比較しにくいものの、)他省庁からの出席の頻度が高く、省庁横断での議論に一層積極性があるように見える
政府における安全性の最新論点について知りたい
調査部会の資料を見ると、細胞性食品について安全性確認上、次の論点整理があったことが読み取れます。
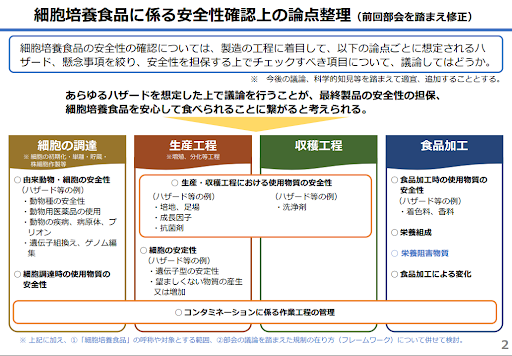
https://www.caa.go.jp/policies/council/fssc/meeting_materials/assets/fscc_cms105_250221_01.pdf
話し合われている内容をよく見てみると、これまでの食品づくりでも扱われてきたようなテーマがたくさんあるんです。たとえば、動物用の薬、食品をつくる工場での管理方法、食品に使われる添加物や加工技術 などなど。つまり、「まったく新しいから何もわからない」わけではなくて、今までの知識やルールが活かせそうなところも多いというわけです。
実は、世界の食品の安全基準を話し合っているコーデックス委員会(国際食品規格委員会)という場があります。
それをサポートしているWHO(世界保健機関)とFAO(国連食糧農業機関)が、細胞性食品についてレポートをまとめたことがあります。(こちら:https://www.who.int/publications/i/item/9789240070943)。
このレポートの中には、こんなふうに書かれていました:“The experts found that for cell-based food, many hazards are already well-known, and they exist in conventionally produced food.”(専門家は、細胞性食品において多くの危険因子が既に広く知られており、従来の製造方法による食品にも存在することを指摘しました。)
たしかに、多くの部分はこれまでの食品づくりと共通しています。でも、やっぱり気になるのは、
「じゃあ、逆に“共通しない”部分って、どこなの?」
というところですよね。今後上記のスライドよりも細かい議論結果が発表されると思われます。政府としての見解が発表される際には、従来食品に近い点とそうでない点を分けて整理することが、消費者コミュニケーションにとって重要となり得ます。
今後の議論のポイントについて知りたい
今後の政府の議論を追ううえでどの点に注目すればよいかについて、下記に筆者の私感を整理しました。国内の販売事例第一号がいつになるかという点に影響しそうな項目を中心に挙げています。
- ガイドラインの粒度
- 開発企業に求められる安全性に関する情報整理の粒度は?
- 各安全性情報の取得方法に関する細かい指示はある/ない?
- 「実際これどう測定するの?どう評価するの?」というものがちらほらあります。行政からの指定がない場合、測定方法や評価方法の開発もしないといけません。また、開発も企業の独断ではできず、行政機関と企業間で相談のうえ方法を選ぶことになる可能性があります。その場合、管理項目を決めたその先にも、まだまだやることが山積みという状況です
- ガイドラインの範囲
- 企業の責任の範囲と、政府で確認・情報収集する範囲がどんなバランスになるのか
- 従来の食品と同等のハザードについては、社会的にも対応経験があるとみなし、企業の責任でキチンと対応してもらおう。その一方で、新規のハザードについては、政府でもみますよ、となるのか
- ガイドラインの更新有無やその場合の体制
- 申請された情報に基づいて、日本として本食品の知見が蓄積されてくれば、ガイドラインの見直しもなされるはず
- 多様性があり、かつ日々開発がすすむ細胞性食品分野、ひいては新開発食品全般において、開発を独り歩きさせないよう、日本として食品安全評価のシステムをどのように体制強化していくのか
- 政府で確認・情報収集する範囲が設置された場合、その体制や承認のレベル
- 担当はどこの省庁?
- 何人体制?
- 届け出制?・承認制?・その他?
- 既存法との整合性はどうなるの?
- 調査部会でガイドラインが策定されてから受付開始まで、どの程度の調整・実装期間が必要となるか
- 消費者へのリスクコミニュケーションとしてどういった計画があるか
終わりに
7月25日は今年度第1回目の調査部会での細胞性食品の議論が行われます。また新しいことが分かり次第、私感を交えて解説したいと思います。引き続きどうぞよろしくお願いいたします。
※7月23日に次のタイポを修正いたしました。大変失礼いたしました。:「2026年3月期(2025年度)の最初の半年は→2025年3月期(2024年度)の最初の半年は」、「2025年度は(調査部会は…)→2024年度は(調査部会は…)」


